本文来自公众号仁生泽发

口服富勒烯
恢复肠道氧化还原稳态
以解决全身炎症,预防远程心肌损伤
01
研究背景
心血管疾病是全球死亡的主要原因(1)。心肌梗死(MI)可导致冠状动脉闭塞引起的严重心肌缺血性坏死(2)。临床上治疗心肌梗死最有效的方法是再灌注,例如介入或溶栓治疗(3-5)。然而这些疗法可能会进一步诱导心肌缺血/再灌注损伤(MI/RI)以及更严重的心肌损伤。MI和MI/RI下心肌损伤的明显病理特征是免疫功能障碍引起的过度炎症增加(6)。然而心脏组织的独特结构导致静脉注射免疫调节剂的滞留受限。因此迫切需要探索新的治疗药物来有效保护心血管。
02
摘要
中国科学院化学研究所的白春礼/王春儒团队在《美国国家科学院院刊》PNAS上发表了题为“Recovering intestinal redox homeostasis to resolve systemic inflammation for preventing remote myocardial injury by oral fullerenes”的文章,研究了一种有效的心血管保护策略,以防止心肌损伤。由于心脏组织的独特结构限制了传统治疗方式的应用,因此作者提出了通过口服富勒烯nanoscavenger(OFNS)维持肠道氧化还原平衡,从而解决全身炎症并预防远端心肌损伤的新方法。实验结果表明,OFNS能够显著减少肠道和全身炎症,并有效地预防心肌损伤。此外,通过对转录组和蛋白质组的定量分析,研究人员揭示了OFNS在调节肠道免疫稳态方面的潜力。这项研究为心血管疾病的治疗提供了新的思路和方向。

03
结果与讨论
作者首先是通过混合造粒机将C60粉末与各种两亲性补充剂混合制备的,包括微晶纤维素(MCC)、羧甲基纤维素(CMC)、羟丙基纤维素(HPC)和其他药用辅料(硅胶、共聚维酮、硬脂酸镁) (Fig. 1A)。然后将混合物压制成片剂。将它们进一步分解成水,形成分散液。然后,用环境扫描电子显微镜检测OFNS分散体在水中的粒径,电子自旋共振(ESR)光谱测试OFNS的•OH清除能力(Fig. 1 C and D)。在体外实验中,作者使用了三种细胞模型大鼠小肠上皮细胞(IEC-6)、人脐静脉内皮细胞(HUVEC)以及小鼠单核巨噬细胞(RAW264.7)来探究 OFNS 对细胞氧化应激、炎症损伤、细胞毒性和凋亡的影响。结果显示,OFNS 能够显著降低细胞内的 ROS 含量,增强细胞活力,抑制细胞凋亡并缓解炎症。

Fig 1:OFNS 的体外制备和表征
随后作者评估了OFNS在大鼠体内的生物分布和急性毒性。通过液相色谱-质谱法测定C60的含量。结果显示,OFNS主要积聚在肠道中,很少积聚在主要器官和循环系统中,这表明OFNS几乎没有被吸收(Table S1)。此外检测了OFNS的排泄率,在口服OFNS后2小时、4小时、8小时、12小时、24小时、48小时和72小时收集粪便(Table S2)。发现C60的含量在8至12小时内高达70.26%,OFNS的排泄率在24小时内达到97.43%,这表明OFNS大多随时间以粪便形式排出体外。
Table:OFNS在体内的分布和OFNS在粪便中的排泄
对大鼠口服了极高剂量的OFNS(5000mg/kg)评估OFNS的急性毒性,作者发现,在2周的观察期间,没有一只大鼠死亡。还对观察结束时的体重、器官指数和主要器官(心脏、肝脏、脾脏、肾脏和肺)的组织病理学进行了统计分析(Fig 2),所有这些都表明OFNS对大鼠的急性毒性很小。

Fig 2:OFNS的急性毒性评估
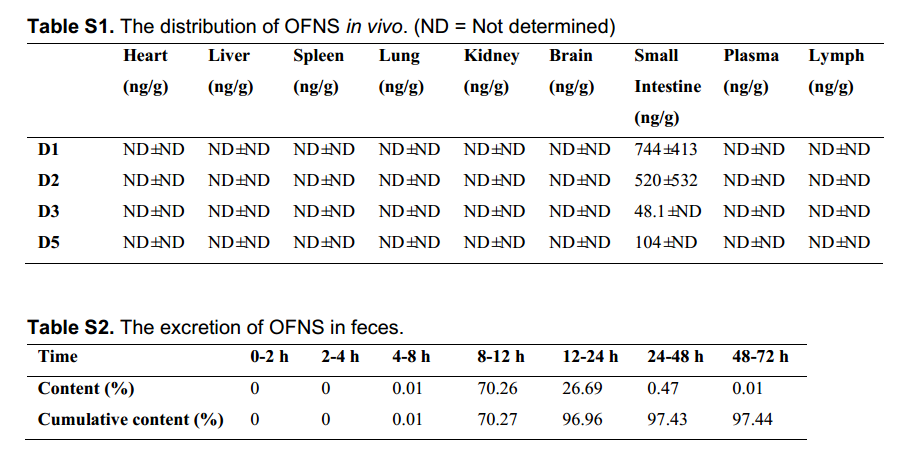
基于上述发现作者验证了OFNS对MI/RI心肌损伤的治疗作用,以依达拉奉(EDA)作为阳性对照连续给药14天(Fig 3A)。通过超声心动图评估OFNS对心肌损伤的影响(Fig 3B)、Masson染色测量心肌纤维化的程度(Fig 3C)、HE染色观察小鼠的肠道病理变化(Fig 3E)、Ki67染色测量的肠细胞增殖(Fig 3F)Western blot检测ZO-1和occludin在内的蛋白质显著上调(Fig 3K)。结果表明OFNS有效地调节了MI/RI小鼠的肠道氧化还原稳态,恢复了功能失调的肠道屏障。
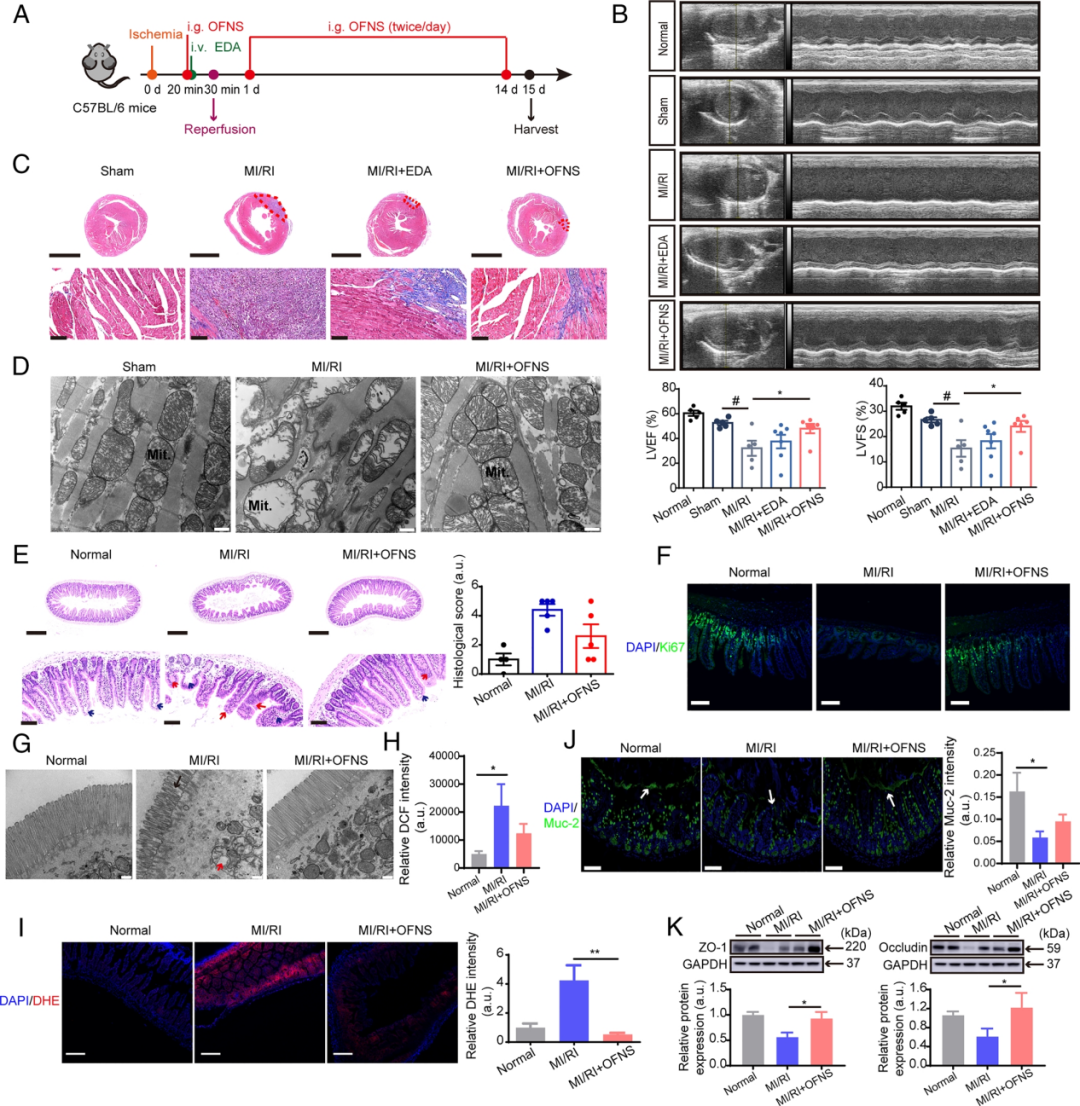
Fig 3:OFNS对MI/RI小鼠心肌损伤和肠道稳态的影响
接下来作者通过探索肠道组织的定量转录组学和蛋白质组学,深入揭示OFNS治疗对肠道稳态的分子机制。对于转录组,鉴定和定量了17739个基因,5629个mRNA发生了显著变化(Q<0.05)。MI/RI+OFNS组与MI/RI组有320个差异mRNA(Fig 4A)。对于蛋白质组学,鉴定了6448种蛋白质,定量了5572种蛋白质。正常组和MI/RI组之间有765个差异表达蛋白,MI/RI和OFNS+MI/RI之间有918个差异表达蛋白质。研究发现,这些差异表达蛋白主要参与免疫反应、补体激活(替代途径和经典途径),与正常组相比,MI/RI组代谢途径过程中的大多数差异蛋白以及补体和凝血级联明显下调。值得注意的是,这些差异蛋白在OFNS处理后显著上调。
Fig 4:定量转录组学和蛋白质组学分析
对于代谢途径,作者检测了包括Gpx-3、Parp1、Cox5a、LDHa、细胞色素C、Fabp1等在内的蛋白质表达。可以发现,OFNS治疗后这些蛋白质的表达没有显著变化(Fig 5)。对于补体和凝血级联,作者检测了包括C3、C4b、F12、Plg、F13a1等在内的蛋白质表达。发现补体系统经典和替代途径中最核心的分子C3的表达在MI/RI模型组中高度降低。值得注意的是,OFNS逆转了C3的异常下降(Fig 6A)。补体和凝血级联与先天免疫和适应性免疫密切相关(7,8),因此作者进一步研究了中性粒细胞、巨噬细胞以及使用免疫荧光染色或FCM检测OFNS处理后MI/RI小鼠肠道中T细胞的含量。OFNS可以降低MI/RI小鼠中性粒细胞和巨噬细胞的含量以及促炎细胞因子,包括TNF-α、IFN-γ和IL-6,表明OFNS治疗后MI/RI诱导的炎症明显缓解(Fig 6B和C)。此外,OFNS显著提高了MI/RI小鼠肠道中T细胞的总含量(Fig 6D)。这些结果表明,OFNS可以缓解炎症,恢复MI/RI小鼠肠道的免疫稳态。
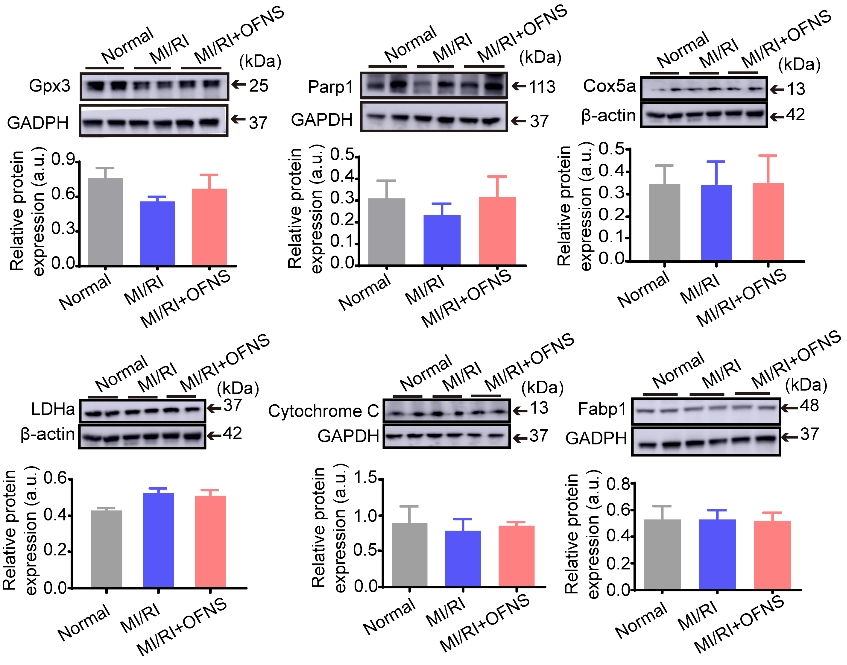
Fig 5:Gpx3、Parp1、Cox5a、LDHa、细胞色素C和Fabp1的相对蛋白表达。

Fig 6:OFNS治疗后肠道免疫和全身炎症的测量
最后作者使用小鼠和小型猪的MI模型进一步评估了OFNS对缺血性心肌损伤的影响。通过用无菌丝线紧紧结扎左前降支冠状动脉,直至第3天实验结束,获得携带MI的小鼠(Fig 7A)。OFNS连续给药3天,所有小鼠实施安乐死。根据图5B中心脏的病理图像,作者观察到与假手术组相比,OFNS显著减少了MI小鼠的梗死面积。此外,心肌损伤标志物包括肌酸激酶心肌带同工酶和心肌肌钙蛋白T在心肌梗死小鼠中异常增加(Fig 7C和D)。值得注意的是,OFNS治疗后,这两种情况都显著降低。此外,心肌梗死小鼠的异常氧化应激相关指标,包括锰超氧化物歧化酶(Mn-SOD)和丙二醛(MDA),在OFNS治疗后几乎恢复到正常水平(Fig 7E和F)。为了进一步检测心肌活力,作者进行了18F-脱氧葡萄糖(18F-FDG)正电子发射断层扫描-计算机断层扫描(PET-CT)测试((Fig 7I)。子弹图和冠状断面图均显示,OFNS治疗后代谢缺陷区域显著减少((Fig 7J)。总的来说,OFNS显著预防了小鼠和小型猪心肌梗死后的缺血性心肌损伤。
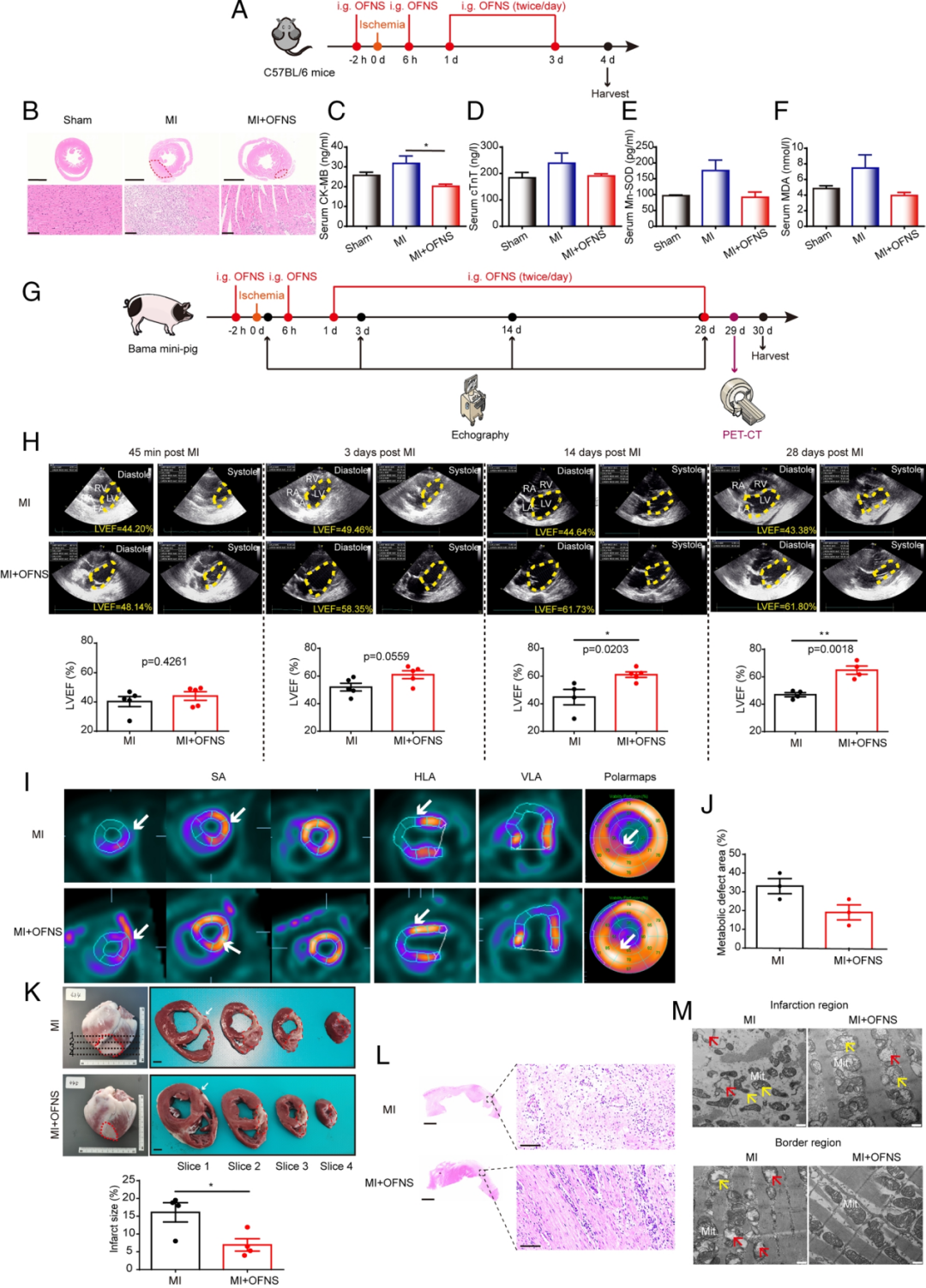
Fig 7:OFNS对小鼠和小型猪的抗心肌梗死作用
04
结论
在这项研究中,提出了一种通过沿心脏-肠道免疫轴的双向交流来保护心肌免受损伤的策略(Fig 8)。具体来说,作者探索了抗氧化OFNS 调节肠道氧化还原稳态,减少全身炎症,预防远端心肌损伤。此外,作者将这一原理应用于治疗小鼠和小型猪的急性心肌梗死。为缓解过度炎症和远程组织损伤提供了一条通用而有效的途径。
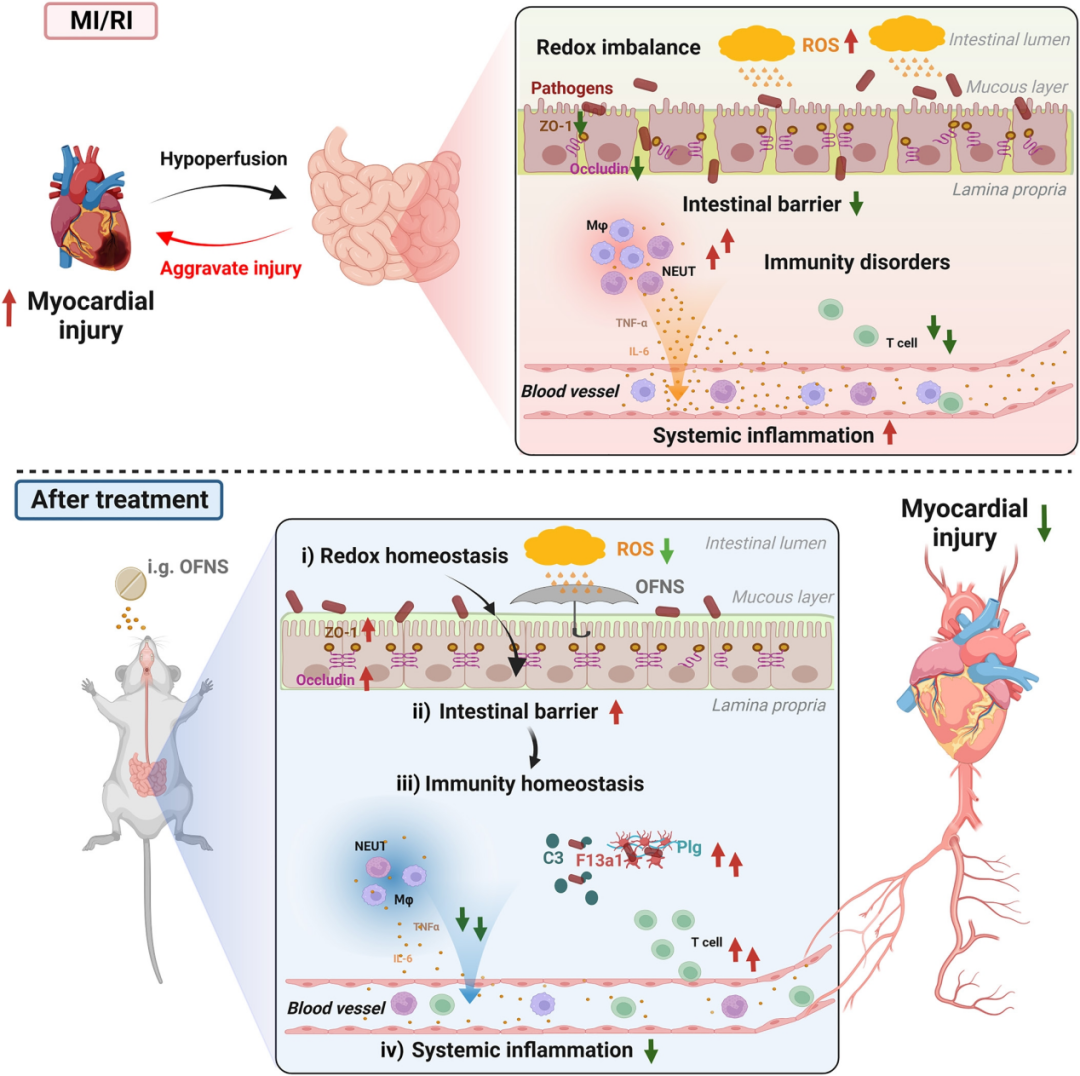
Fig 8:OFNS预防MI/RI小鼠心肌损伤的机制图
05
作者信息
中国科学院化学研究所的贾旺为本文的第一作者,白春礼院士和王春儒研究员为本文的通讯作者。中国科学院化学研究所为第一单位,中国科学院大学、北京福纳康生物技术有限公司、赤峰福纳康生物技术有限公司以及中国科学院上海药物研究所为共同完成单位。
参考文献:
1. G. A. Roth et al., Global burden of cardiovascular diseases and risk factors, 1990–2019: Update from the GBD 2019 study. J. Am. Coll. Cardiol. 76, 2982–3021 (2020).
2. P. Dutta et al., Myocardial infarction accelerates atherosclerosis. Nature 487, 325–329 (2012).
3. T. Zhao et al., Reactive oxygen species-based nanomaterials for the treatment of myocardial ischemia reperfusion injuries. Bioact. Mater. 7, 47–72 (2022).
4. G. Heusch, Myocardial ischaemia-reperfusion injury and cardioprotection in perspective. Nat. Rev. Cardiol. 17, 773–789 (2020).
5.D. M. Yellon, D. J. Hausenloy, Myocardial reperfusion injury. N. Engl. J. Med. 357, 1121–1135 (2007).
6. G. J. Koelwyn et al., Myocardial infarction accelerates breast cancer via innate immune
reprogramming. Nat. Med. 26, 1452–1458 (2020).
7.Z. Bekassy, I. Lopatko Fagerström, M. Bader, D. Karpman, Crosstalk between the renin–angiotensin, complement and kallikrein–kinin systems in inflammation. Nat. Rev. Immunol. 22, 411–428 (2022).
8. J. Ochando, F. Ordikhani, P. Boros, S. Jordan, The innate immune response to allotransplants: Mechanisms and therapeutic potentials. Cell. Mol. Immunol. 16, 350–356 (2019).
